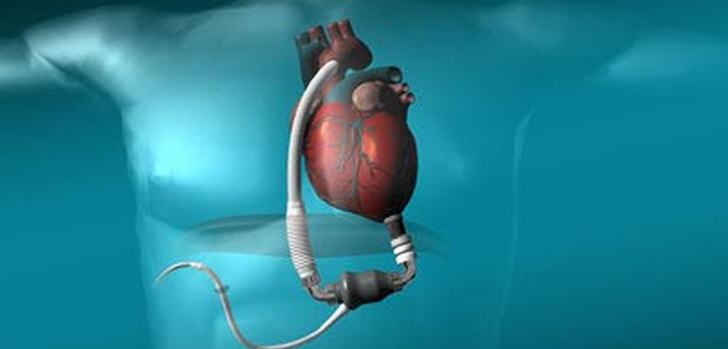
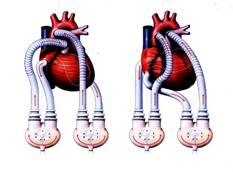
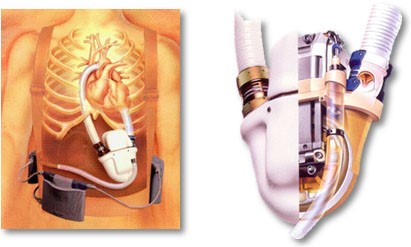
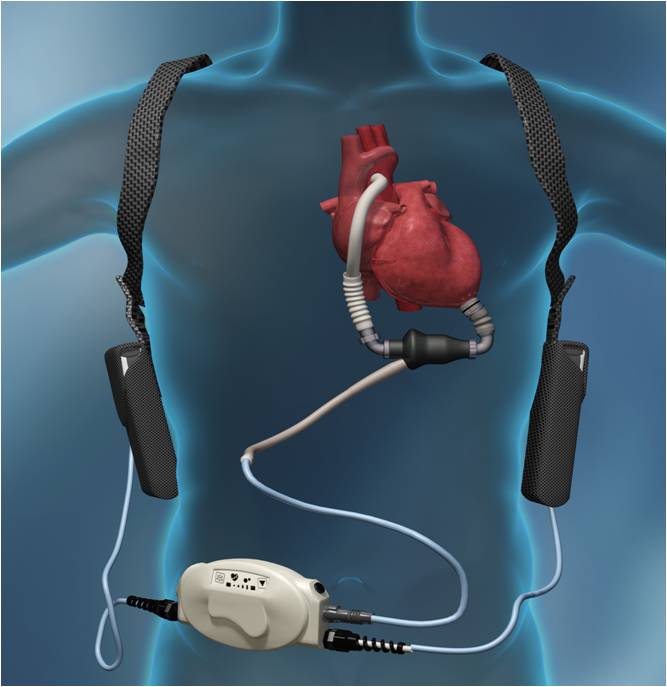
L’amélioration des résultats à long terme de la transplantation cardiaque, depuis l’utilisation d’immunosuppresseurs puissants, a conduit à une augmentation des indications. Malheureusement, il existe actuellement une inadéquation entre le nombre de candidats potentiels à une transplantation cardiaque et le nombre de greffons disponibles. Il en résulte un allongement de l’attente sur les listes de transplantation, avec la possibilité d’une détérioration, parfois aiguë, de l’état hémodynamique. Malgré des traitements médicaux de plus en plus efficaces, un certain nombre de situations hémodynamiques précaires ne peuvent être résolues que par l’utilisation d’une assistance circulatoire mécanique.
Si des paramètres hémodynamiques ont été initialement proposés avant l’implantation d’une assistance circulatoire mécanique (index cardiaque < 2 L.min-1.m-2, pression artérielle systolique < 90 mmHg, pressions de remplissage élevées) accompagnés d’une oligurie (diurèse < 30 mL.min-1) ou d’une anurie depuis moins de 6 heures, et cela malgré un traitement médical optimum.
Cette notion de traitement médical optimum est cependant difficile à définir. La combinaison de plusieurs catécholamines à doses élevées est néfaste sur la survie de ces patients. Plus que les doses de catécholamines au moment du bilan hémodynamique, il faut considérer la nécessité d’augmenter progressivement ces doses.
D’autre part, des patients peuvent être pauci symptomatiques alors même que leur index cardiaque est inférieur à 1,6 L.min-1.m-2. C’est le cas particulièrement de patients présentant une cardiopathie chronique et ayant spontanément limité leur activité physique. A l’inverse, des patients présentant un index cardiaque supérieur à 2 L.min-1.m-2 peuvent présenter des signes évidents de défaillance cardiaque avec des signes de bas débit périphérique. C’est donc sur un faisceau d’arguments cliniques, hémodynamiques et para cliniques que la décision d’implantation d’une assistance circulatoire mécanique doit être prise.
La comparaison des courbes actuarielles de survie des patients sous traitement médical et sous assistance mécanique est en faveur de cette dernière, et cela surtout pour une implantation précoce.